ThS BS Trần Hữu Hiền
Thành viên hội Nghiên Cứu Gan Châu Âu
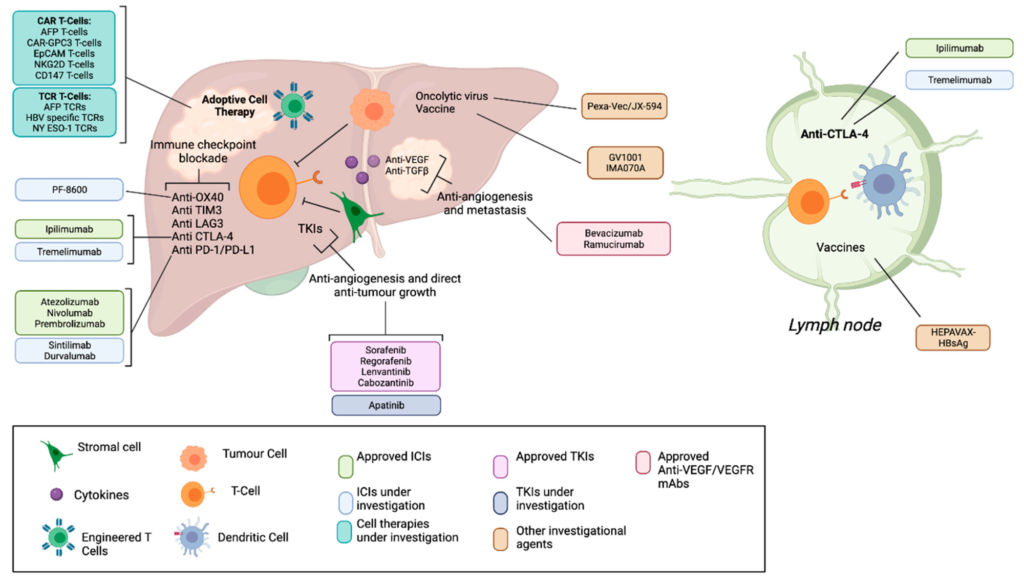
1. Ung thư biểu mô tế bào gan (HCC) là gì và tại sao nó nguy hiểm?
Hỏi: HCC là gì và tại sao nó lại là một vấn đề lớn đối với sức khỏe?
Đáp: Ung thư biểu mô tế bào gan (HCC) là loại ung thư gan nguyên phát phổ biến nhất, chiếm khoảng 80% các trường hợp ung thư gan. Đây là một trong những nguyên nhân hàng đầu gây tử vong liên quan đến ung thư trên toàn thế giới. HCC nguy hiểm vì hầu hết bệnh nhân được chẩn đoán khi bệnh đã ở giai đoạn muộn, không thể chữa khỏi bằng phẫu thuật hay các phương pháp thông thường. Các yếu tố như viêm gan B, viêm gan C, bệnh gan nhiễm mỡ không do rượu và nghiện rượu làm tăng nguy cơ mắc bệnh. Tiên lượng thường kém vì các phương pháp điều trị hiện tại chỉ mang lại lợi ích hạn chế.
2. Liệu pháp miễn dịch là gì và tại sao nó được dùng cho HCC?

Hỏi: Liệu pháp miễn dịch là gì? Nó có vai trò gì trong điều trị HCC?
Đáp: Liệu pháp miễn dịch là phương pháp sử dụng hệ thống miễn dịch của cơ thể để chống lại ung thư. Trong trường hợp HCC, hệ miễn dịch có thể nhận biết các tế bào ung thư là “kẻ thù” và tấn công chúng. Tuy nhiên, HCC thường tạo ra một môi trường ức chế miễn dịch, khiến các tế bào miễn dịch hoạt động kém hiệu quả. Liệu pháp miễn dịch, bao gồm các thuốc ức chế điểm kiểm soát miễn dịch (immune checkpoint inhibitors – ICIs) và liệu pháp tế bào (cellular therapies), được phát triển để tăng cường khả năng của hệ miễn dịch, giúp nó nhận diện và tiêu diệt tế bào ung thư tốt hơn. Với HCC, đây là hướng đi mới đầy hứa hẹn vì các phương pháp truyền thống như thuốc nhắm mục tiêu (TKIs) hay hóa trị chỉ cải thiện thời gian sống sót một cách khiêm tốn.
3. Các phương pháp điều trị hiện tại cho HCC là gì?
Hỏi: Hiện nay HCC được điều trị như thế nào?
Đáp: Điều trị HCC phụ thuộc vào giai đoạn bệnh:
- Giai đoạn sớm: Phẫu thuật cắt bỏ khối u, ghép gan hoặc đốt sóng cao tần (ablative therapy).
- Giai đoạn trung gian: Điều trị qua động mạch (trans-arterial therapy) như hóa tắc mạch (TACE).
- Giai đoạn tiến triển: Sử dụng thuốc nhắm mục tiêu như sorafenib (tăng thời gian sống từ 7,9 lên 10,7 tháng), lenvatinib, regorafenib, cabozantinib hoặc kháng thể đơn dòng ramucirumab. Gần đây, liệu pháp miễn dịch kết hợp atezolizumab (ức chế PD-L1) và bevacizumab (ức chế VEGF) đã trở thành tiêu chuẩn đầu tay vì cho kết quả sống sót tốt hơn sorafenib. Tuy nhiên, chỉ một số ít bệnh nhân đáp ứng tốt với các phương pháp này, nên cần các cách tiếp cận mới như liệu pháp tế bào.
4. Liệu pháp tế bào miễn dịch là gì?
Hỏi: Liệu pháp tế bào miễn dịch là gì và nó khác gì với các phương pháp khác?
Đáp: Liệu pháp tế bào miễn dịch (adoptive cellular therapy – ACT) là một dạng của liệu pháp miễn dịch, trong đó các tế bào miễn dịch (thường là tế bào T) được lấy từ cơ thể bệnh nhân, được cải tiến trong phòng thí nghiệm để tăng khả năng tấn công ung thư, sau đó đưa trở lại cơ thể. Các loại chính bao gồm:
- Tế bào T thụ thể kháng nguyên chimeric (CAR-T): Tế bào T được gắn một thụ thể nhân tạo để nhận diện kháng nguyên trên bề mặt tế bào ung thư.
- Tế bào T thụ thể T cải tiến (TCR-T): Tế bào T được chỉnh sửa để nhận diện kháng nguyên bên trong tế bào ung thư qua phức hợp MHC.
- Tế bào tiêu diệt gây ra bởi cytokine (CIK): Tế bào miễn dịch không đặc hiệu kháng nguyên, được kích hoạt bởi cytokine.
- Lympho xâm nhập khối u (TILs): Tế bào T lấy từ khối u, được mở rộng số lượng và đưa lại cơ thể.
Khác với thuốc, liệu pháp tế bào nhắm trực tiếp vào tế bào ung thư bằng cách sử dụng “quân đội” miễn dịch của chính bệnh nhân, mang lại tiềm năng điều trị cá nhân hóa.
5. Tế bào CIK hoạt động như thế nào trong điều trị HCC?
Hỏi: Tế bào CIK là gì và chúng giúp ích gì cho bệnh nhân HCC?
Đáp: Tế bào CIK (Cytokine-Induced Killer cells) là một loại tế bào miễn dịch (CD3+ CD56+) được tạo ra từ máu ngoại vi hoặc máu dây rốn, kích hoạt bằng các cytokine như IL-2, IL-1α và IFNγ. Chúng có khả năng tiêu diệt tế bào ung thư mà không cần qua MHC (khác với tế bào T thông thường).
- Hiệu quả: Các nghiên cứu giai đoạn I cho thấy CIK giảm tái phát ở bệnh nhân HCC giai đoạn sớm sau phẫu thuật hoặc TACE, đồng thời làm chậm tăng trưởng khối u và giảm tải lượng virus viêm gan B ở bệnh nhân giai đoạn muộn. Khi kết hợp với TACE, CIK tăng thời gian sống không tiến triển (PFS) và sống sót toàn bộ (OS) so với TACE đơn thuần (OS: 31 tháng so với 10 tháng).
- An toàn: CIK được dung nạp tốt, ít gây tác dụng phụ nghiêm trọng như bệnh ghép chống chủ (GvHD).
Hiện nay, CIK đang được thử nghiệm thêm, đặc biệt khi kết hợp với các phương pháp khác như tế bào dendritic (DCs) hoặc sorafenib.
6. TILs là gì và chúng có được dùng cho HCC không?
Hỏi: TILs là gì? Chúng có hiệu quả với HCC không?
Đáp: TILs (Tumor Infiltrating Lymphocytes) là tế bào T được lấy từ khối u của bệnh nhân, mở rộng số lượng trong phòng thí nghiệm và đưa trở lại cơ thể để tấn công ung thư. Chúng đã thành công trong ung thư hắc tố (melanoma) với tỷ lệ đáp ứng 49-72%.
- Ứng dụng trong HCC: Trong HCC, TILs thường bị kiệt sức (exhausted), biểu hiện các dấu hiệu như TIM-3 và LAG-3, làm giảm khả năng tiết cytokine chống ung thư. Các nghiên cứu tiền lâm sàng cho thấy việc chặn TIGIT và PD-1 có thể cải thiện chức năng của TILs. Tuy nhiên, hiện tại chỉ có một thử nghiệm lâm sàng (NCT04538313) đang nghiên cứu TILs cho HCC tái phát nguy cơ cao, và chưa có nhiều dữ liệu lâm sàng. Cần thêm nghiên cứu để đánh giá tiềm năng của TILs trong HCC.
7. CAR-T là gì và nó được dùng thế nào cho HCC?
Hỏi: CAR-T là gì? Nó hoạt động ra sao trong điều trị HCC?
Đáp: CAR-T (Chimeric Antigen Receptor T-cells) là tế bào T được chỉnh sửa gen để mang một thụ thể nhân tạo (CAR) nhận diện kháng nguyên trên bề mặt tế bào ung thư mà không cần qua MHC. CAR-T đã rất thành công trong ung thư máu (như CD19-CAR-T cho bệnh bạch cầu).
- Ứng dụng trong HCC: CAR-T đang được thử nghiệm cho HCC với các mục tiêu như:
- Glypican-3 (GPC3): Một protein trên bề mặt tế bào HCC (72% trường hợp), ít xuất hiện ở mô lành. Thử nghiệm giai đoạn I cho thấy CAR-T nhắm GPC3 an toàn, với 1/13 bệnh nhân đáp ứng một phần (PR), nhưng hiệu quả còn hạn chế (OS trung bình 1 năm là 42%).
- Alpha-fetoprotein (AFP): Một protein trong tế bào HCC, được nhắm qua MHC. CAR-T nhắm AFP cho thấy hiệu quả trong mô hình tiền lâm sàng, nhưng thử nghiệm lâm sàng (NCT03349255) đã bị dừng mà chưa có kết quả.
- c-MET: Một thụ thể liên quan đến tăng trưởng khối u, CAR-T nhắm c-MET + PD-L1 cho kết quả tốt trong mô hình tiền lâm sàng.
- MUC1: Một protein màng liên quan đến di căn, đang thử nghiệm (NCT02587689).
- NKG2DL: Một protein trên HCC, CAR-T nhắm NKG2DL hiệu quả trong mô hình tiền lâm sàng, nhưng chưa có dữ liệu lâm sàng rõ ràng.
- Thách thức: CAR-T gặp khó khăn trong HCC do thiếu kháng nguyên đặc hiệu, môi trường ức chế miễn dịch trong khối u và nguy cơ độc tính ngoài mục tiêu. Các thế hệ CAR-T mới (thế hệ 3, 4) với cytokine như IL-15/IL-21 đang được phát triển để cải thiện hiệu quả.
8. TCR-T là gì và nó khác CAR-T như thế nào?
Hỏi: TCR-T là gì? Nó khác CAR-T ở điểm nào khi điều trị HCC?
Đáp: TCR-T (T-Cell Receptor Transduced T-cells) là tế bào T được chỉnh sửa gen để mang thụ thể TCR đặc hiệu nhận diện kháng nguyên bên trong tế bào ung thư qua phức hợp MHC.
- Khác biệt với CAR-T:
- CAR-T nhắm kháng nguyên bề mặt, không cần MHC, trong khi TCR-T nhắm kháng nguyên nội bào qua MHC, đòi hỏi khớp HLA (thường là HLA-A*02:01).
- TCR-T có thể nhắm các mục tiêu sâu hơn trong tế bào, nhưng bị giới hạn bởi yêu cầu HLA, làm giảm số lượng bệnh nhân đủ điều kiện.
- Ứng dụng trong HCC:
- AFP: TCR-T nhắm AFP 158–166 (NCT03132792) cho thấy 5/5 bệnh nhân đạt ổn định bệnh (SD) ở liều thấp, 1/3 đạt PR ở liều cao, an toàn tốt.
- HBV: TCR-T nhắm kháng nguyên virus viêm gan B (HBsAg) giảm tải lượng virus ở một bệnh nhân sau ghép gan mà không gây hại mô lành.
- Tiềm năng: TCR-T phù hợp cho HCC liên quan đến HBV, nhưng cần cải thiện độ nhạy và giảm nguy cơ tổn thương gan lành.
9. Liệu pháp tế bào có an toàn không? Có tác dụng phụ gì?
Hỏi: Liệu pháp tế bào có rủi ro gì không? Tôi có thể gặp tác dụng phụ nào?
Đáp: Liệu pháp tế bào có tiềm năng nhưng cũng đi kèm rủi ro:
- CIK: Thường an toàn, ít tác dụng phụ nghiêm trọng, không gây GvHD.
- TILs: Chưa có dữ liệu lâm sàng đủ để đánh giá, nhưng có thể gây mệt mỏi do IL-2 dùng kèm.
- CAR-T:
- Hội chứng giải phóng cytokine (CRS): 69% bệnh nhân GPC3-CAR-T gặp CRS (nhẹ), 1/13 tử vong do CRS cấp 5.
- Độc tính ngoài mục tiêu: Có thể tấn công mô lành nếu kháng nguyên xuất hiện ở đó.
- TCR-T: An toàn tốt trong thử nghiệm AFP, nhưng nguy cơ tổn thương gan lành ở HCC liên quan HBV.
Các nhà khoa học đang phát triển “công tắc an toàn” (như hệ thống tet-on với doxycycline) để kiểm soát hoạt động của tế bào T, giảm độc tính.
10. Tương lai của liệu pháp tế bào cho HCC là gì?
Hỏi: Liệu pháp tế bào sẽ phát triển như thế nào để giúp bệnh nhân HCC trong tương lai?
Đáp: Liệu pháp tế bào cho HCC còn ở giai đoạn đầu, nhưng có nhiều hướng phát triển:
- Cải thiện CAR-T: Tăng khả năng nhận diện khối u, vượt qua môi trường ức chế (dùng cytokine như IL-15/IL-21), giảm độc tính bằng công nghệ mới.
- TCR-T: Tối ưu hóa độ nhạy TCR, mở rộng đối tượng bệnh nhân qua các HLA khác.
- Kết hợp liệu pháp: Dùng CIK, CAR-T hoặc TCR-T với ICIs, TKIs hoặc TACE để tăng hiệu quả.
- Cá nhân hóa: Phân tích khối u để chọn mục tiêu tốt nhất cho từng bệnh nhân.
Dù còn nhiều thách thức (như chi phí, sản xuất phức tạp), liệu pháp tế bào hứa hẹn sẽ trở thành một phần quan trọng trong điều trị HCC trong tương lai.



